随着人用药品技术要求国际协调理事会(ICH)Q13指南的发布以及多个采用连续制造技术的口服固体制剂获批,药品连续制造在该类产品领域的监管发展受到越来越多的关注。物料处理是连续制造平台重要的组成部分,本研究分析了物料输入、连续给料和连续混合方面的技术特点,介绍了口服固体制剂连续制造的物料处理步骤,并从工艺验证、稳健性、设施设备、过程控制、质量保证和清洁等方面探讨了监管检查的关注点。在相关技术考量方面,工艺设备应能持续稳定地传递物料且尽可能控制风险并降低物料损耗,因此需要深入了解物料特性,科学地设计工艺设备和开展确认验证;在监管检查方面可关注连续工艺的专属风险以及对产品质量可能产生的影响。期望能以此促进连续制造在制药行业的应用,同时也建议监管机构、制药企业以及全社会共同参与,充分运用过程分析技术、创新检验方法和数字化质量保证等手段助力持续生产出符合质量要求的产品,从而推动我国制药工业向高水平现代化迈进。
从全球监管考量来看,美国食品药品监督管理局(FDA)、日本独立行政法人医药品医疗器械综合机构(PMDA) 等也都发布有药品连续制造相关的指南细则[4—7];欧洲药品管理局(EMA) 虽然暂没有提供具体指南,但已通过多种场合表示其目前的监管体系足以支持连续制造的应用[8]。监管考量具有一定的地区特点,相对来说,ICH Q13 总体还是比较框架性的,其延伸更宽泛、包容度更高、在申报资料指导方面更详细;FDA、PMDA 指南相对更具体,在专业领域的聚焦较深、较细[9]。除监管机构外,其他机构或组织也在积极推进先进制造。美国药典委员会在药品连续制造的控制策略标准化、成分表征标准化( 体现在文献标准和实物参比标准)、产品放行标准化、设备/ 系统要求标准化、传感技术标准化以及系统建模标准化方面一直在开展深入研究[10];美国材料与试验协会(ASTM) 于2014 年发布了“制药工业连续工艺应用的标准指南”[11];国际制药工程协会( ISPE) 口服固体实践委员会连续制造分委会2022 年也发布了“良好实践指南:口服固体制剂的连续制造”[12]。这些成果都在推动连续制造创新和变革过程中发挥了重要作用。各指南的侧重点简要对比见表1。
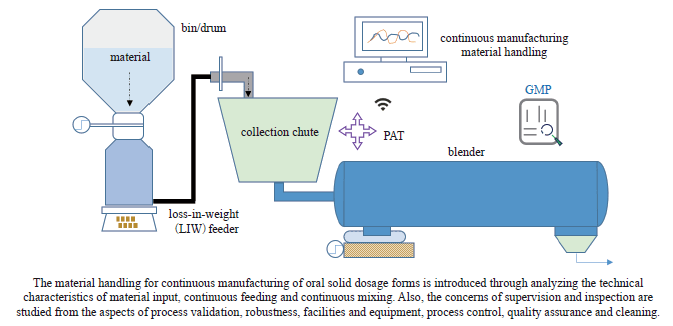
口服固体制剂连续制造已有较为成功的经验,当前阶段的相关探讨也较多聚焦在该领域。物料处理是连续制造平台重要的一部分,应采用合适的设备,使用特性良好的物料,并采取良好的过程控制,使中间品及成品质量始终在其关键质量属性(critical quality attribute,CQA) 受控状态范围内。口服固体制剂生产中,可能涉及液体加工及干燥颗粒加工时的物料特性表征与控制,而物料特性对系统的整体行为起重要的作用,在一定程度上,物料的可变性很可能是影响产品质量的主因,因此充分理解物料性能、合理选取和设计设备,在工艺中通过过程分析技术(process analysis technology,PAT)监控和反馈,动态维持受控状态,更符合质量源于设计(Quality by Design,QbD) 理念。在ICH、FDA 指南的基础上,ISPE 指南从制药工程的角度纳入了口服固体制剂的业界共识,是对监管指南的重要补充。本研究重点参考ISPE 指南的部分内容,讨论在口服固体制剂的连续制造过程中持续稳定处理物料的相关考量,探讨监管检查可能需要关注的要点。
如需获取更多数据洞察信息或公众号内容合作,请联系医药地理小助手微信号:pharmadl001返回搜狐,查看更多