摘要:粉体的性质尤其是流动性对固体制剂的开发和制备具有重要意义。认识和掌握物料的粉体学性质,有助于处方筛选、工艺改进、质量控制、生产等问题的解决。该文通过分析口服固体制剂研发中粉体学方面的常见问题,并结合审评中接触到的实际案例,从审评角度提出了口服固体制剂开发中粉体学指标的控制建议,以期为口服固体制剂的制剂研究和注册申报提供一定的参考。
大约80%的固体制剂及其生产涉及粉末形式成分[1],因此许多制药过程,包括混合、转移、储存、进料、压制和流化等都涉及粉末处理[2]。粉体性质,尤其是流动性对固体制剂的开发和制备具有重要意义,如物料的流动性可能影响赋形剂和生产工艺的选择。因此,认识和掌握物料的粉体学性质,有助于处方筛选、工艺改进、质量控制、生产问题的解决。
粉体学性质研究已成为目前固体制剂审评中常见发补问题。在技术审评过程中,粉体学研究常存在试验目的不明确、考察指标不合理、研究不够充分、质控指标不全面或者缺失研究等问题。随着ICH 在我国的推行,源头控制以及过程控制越来越受到关注,而目前国内尚无系统性的粉体学研究相关技术指南。本文将结合审评过程中显现的常见粉体学问题,探讨粉体学性质与固体制剂关键质量属性、生产工艺的相互关系和影响,提出制剂开发过程中对粉体学研究的一般考虑,以期为固体制剂生产工艺研究提供一些思路和建议。本文仅为个人观点,如与指导原则和法规文件冲突的应以法规为准。
粉体[3]是无数个固体粒子的集合体,其微观性质主要指组成粉体的单个粒子的性质如粒子的大小、形态、比表面积、表面能、表面粗糙度、粒径分布等。这些性质直接影响了粉体流动性,并决定了粉体的其他性质。粉体宏观性质主要指粉体作为一个集合体的性质如粉体的密度与孔隙率[4-5]、吸湿性、润湿性、凝聚性、流动性与充填性[6]、压缩性、以及成形性等。粉体宏观性质受微观性质影响,与制剂的生产密切相关,可通过制剂手段改变粉体微观性质,实现产品质量控制。
上述粉体特性中,粉体流动性尤为重要。国外药典标准中收载的粉体流动性评价指标包括休止角、压缩度(卡尔指数)、Hanusner比(Hanusner ratio,HR)、流出速度和剪切池法等。除流出速度暂无可接受标准外,其余指标与粉体流动特性分类如表1、2所示。由于影响因素较多,准确表征粉体流动性目前仍存在困难。
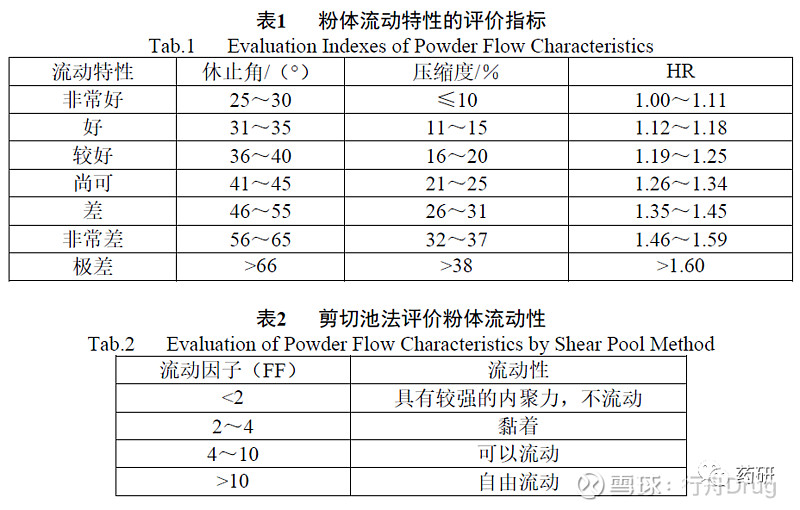
上述表征方法均可用于评价粉体流动性,其中休止角是检验粉体流动性效果较简便的方法,但因涉及主观因素导致重现性差,对生产的指导意义有限;压缩度和HR与产品的堆密度、振实密度直接相关,是同一组数据的不同表达方式,具有较好的重现性;而剪切池法[7]是一种可量化、重现性好的方法,可以直接反映粉体粒子的力学特征,能确定粉体中颗粒的大小、形态、含水量对流动性的影响。在粉体学研究中,推荐使用重现性较好且简单易操作的堆密度和振实密度作为主要考察指标。
物料的粉体学研究对固体制剂的开发具有重要的指导作用,粉体学性质与制剂质量属性之间的关系见表3。
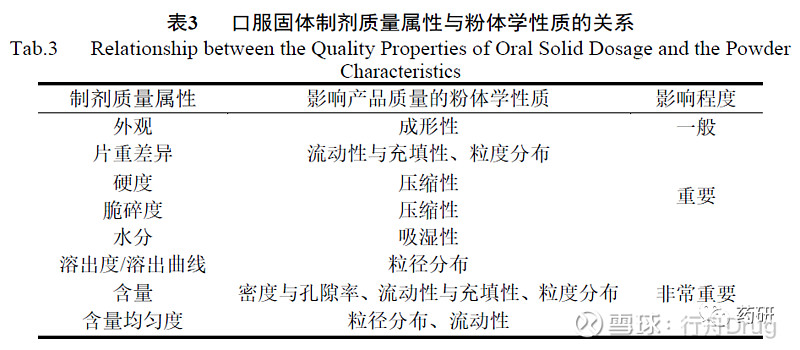
固体制剂工艺中,通过对各种粉体进行加工,改变粉体性质,以达到顺利生产的目的。在产品开发过程中,对中间产品粉体学性质研究不足不但可能会影响对产品质量的整体判断,也可能会在后期产品放大生产时,因缺乏必要的质量桥接,导致产品出现质量问题。
表4 以片剂为例,按生产顺序列出了所有单元操作,呈现了输入物料属性和生产工艺参数对中间产品和终产品(即输出物料)质量属性(尤其是粉体学性质)的影响。

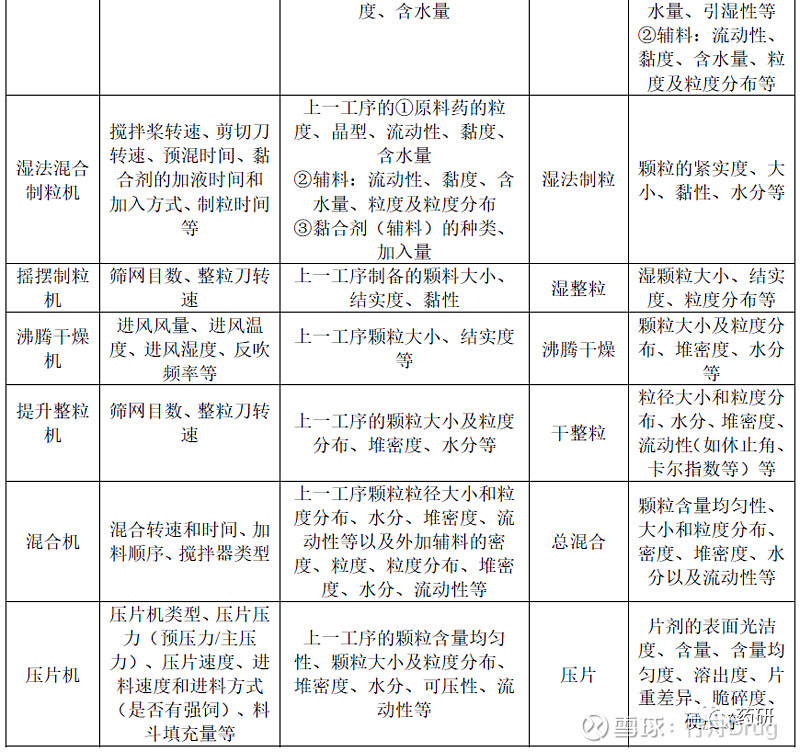
下文将对口服固体制剂生产过程中粉体学控制展开讨论,当采用不同生产工艺时,建议参考ICH Q9[8]进行风险评估,综合考虑原辅料的性质、生产工艺和工艺参数、车间环境以及最差生产条件等,判断哪些输入变量需要进一步研究和控制,以保证产品质量。
粒径是粉体的重要性质,可能会显著影响溶解度、密度、流动性。ICH Q6A[10]中提出了拟定原料药粒度标准的决策树,对于固体制剂,当原料药的粒度对溶出度、溶解度或生物利用度、制剂生产、制剂稳定性、制剂含量均匀度或产品外观等任何一项有影响时,均需制订粒度标准。降低难溶性药物的粒径是提高药物的溶出度、溶出速度以及生物利用度有效的方法。ABUZAR 等[11]使用超临界反流体(SAS)技术来减小阿托伐他汀钙的粒径,经处理后的阿托伐他汀钙在水中的溶解速率较未处理的原料药提高了3.5 倍,且AUC 和cmax 也显著增加。很多申请人在开发阿托伐他汀钙制剂时,均对原料药的粒径进行处理并控制在一定的范围内,旨在实现自制制剂与参比制剂的生物等效(BE)。他达拉非片原研制剂的EMA 审评报告[12]及FDA CMC 审评报告[13]显示,原研制剂对原料药粒径进行了控制。虽然目前原料药的粒径研究已受到研究者的关注,但仍存在原料药粒径控制范围制订依据不够充分等问题。例如,部分申请人仅通过几批小试试验用原料药实测值就确定较宽泛的粒径范围,而原料药粒径批间不一致,拟定粒径可能与注册批次、反映体内疗效的BE 批次原料药粒径相差较大,该粒径范围无质控意义。故建议结合粒度对制剂特性[如采用3 批注册批产品与参比制剂在多种介质(或QC 介质)中进行溶出曲线相似性对比]、生产工艺(如混合均匀性、存放稳定性)等的影响,同时重点关注BE 批次样品的粒径,酌情制定原料药合理的粒径控制范围,为自制和参比制剂的BE 提供更多保证。
此外,粉碎后的原料药长期存放可能会发生粉体凝聚现象,导致自制制剂溶出度下降,溶出曲线与参比制剂不一致。因此,建议申请人在递交资料时应提供粉碎后原料药在规定时间内未发生凝聚的证据,并明确贮藏条件。
审评案例分析:某口崩片所用原料药属于BCS Ⅱ类,申报资料中仅采用多批测定结果作为粒径控制依据,粒径确定依据不足。后要求申请人结合制剂关键批次(包括但不限于BE 批、验证批)所用原料药粒径以及粒径对本品关键质量属性(如溶出度、含量均匀性等)的影响进行研究,合理拟定原料药粒度内控标准,如D10、D50、D90。同时应考虑不同粒径测定方法、不同检测原理,若检测结果差异较大,需验证粒径研究方法。该口崩片采用粉末直压生产工艺,原料药占片剂总重的20%左右;添加辅料微晶纤维素、甘露醇、木糖醇作为填充剂和矫味剂,未对辅料粒径控制,为确保混合均匀性,建议对处方中占比较大的辅料粒径进行研究,并拟定合理限度,确保生产时粉体充分混匀。在生产时,还应增加混合粉末的混合均匀性检查,按照相关指导原则,确认取样位置和取样量。
另外,原料药的粒度也可能会影响制剂的生产工艺,EMA 审评报告显示[14]泊沙康唑肠溶片原研制剂采用固体分散(热熔挤出)技术制备;部分申请人在申报资料中仅提供固体分散体的粒度研究,缺少对原料药粒径的控制。由于原料药初始粒径可影响其与载体材料的混合均匀性,二者粒径差异较大时可发生分层,同时也影响制备固体分散体时的熔化速度。在采用类似工艺生产时,应根据物料的混合均匀性以及熔化时间来确定原料药可接受的粒径范围,并根据下一步生产工序的需要来确定固体分散中间体的粒度分布范围。
药用辅料直接参与到药物制剂的成型、崩解、溶出、缓释和控释等过程,会影响药品的质量、安全性和有效性,因此确定辅料的微粒性质对保证制剂质量有重要意义[15]。
在药物制剂中使用的药用辅料通常具有特定的功能性,对辅料功能性指标的测定、分级和制定限度范围事保证制剂质量的前提。如粒径属于辅料的功能性指标,其中稀释剂的粒径可能影响固体制剂的成型性[ChP(2020年版)四部9601药用辅料功能性相关指标指导原则]。有文献[16]表明不同型号的甘露醇具有不同的粉末性质,包括粒度、流动性和结晶等,其差异可能影响成品质量。对于辅料的控制,申请人应评估不同来源、不同批次、不同型号的辅料对制剂质量(如溶出度、含量均匀度等)及生产工艺的影响,不能仅限于满足通用性标准,应根据剂型需要确定辅料的功能性指标,来制定合理的辅料内控标准(如粒度、堆密度等),以保证药物制剂顺利生产。
制粒工艺可有效改善颗粒属性,通过增大粒径来获得足够的流动性,也可增加紧实性、充填性以及可压性,防止混合后物料成分离析。另外,颗粒的密度、粒径分布等也会影响固体制剂的含量均匀性、溶出度等质量属性。
恩替卡韦片原研制剂EMA审评报告[17]显示,采用湿法制粒工艺可较大程度减少API物理性质(如粒度、形状和表面积)对成品含量均匀度的影响。颗粒性质(表面和体积)主要受颗粒加工方法和参数影响[18]。审评结果显示制粒工序研究中常见问题是生产工艺及工艺参数的确定过于简单,仅根据小试试验或者经验值就确定较宽泛的工艺参数范围,忽略了工艺参数间存在的交互作用以及可能存在的放大效应,可能会导致颗粒的粉体学特征(如粒度分布、堆密度等)不能重现,从而导致产品质量问题或者生产工艺放大失败。
审评案例分析1:如某制剂采用湿法制粒工艺,小试研究采用手工操作,20目金属筛网制粒,所得颗粒大小均匀、紧实度适中,所得片剂质量均一,符合质量标准。工艺验证时采用20 目尼龙筛制粒,最终大生产样品的溶出度批间均一性较差。后对不同批量下颗粒粒度分布、堆密度检测,发现采用尼龙筛网出现了较大较硬的颗粒。最终通过在生产中明确了生产设备材质,并在生产过程中增加粉体学指标等过程控制(如粒度分布等),以保证产品顺利放大生产。为保证输出物料的性质,建议申请人可参照表4,在产品开发中对物料和生产工序进行风险评估,对影响颗粒成型的较关键的输入变量(包括物料和工艺参数)如搅拌桨转速与时间、剪切刀转速与时间以及润湿剂或黏合剂的种类、加入量、加入时间等进行考察。建议以输出物料的粉体学性质、溶出曲线等为考察指标,对某些关键工艺参数进行最差条件试验,并在放大/验证过程中有针对性的进行参数变化,确定最佳参数范围,同时体现在生产工艺信息表中。
对于干法制粒工艺,容易出现制粒过程中粘冲,输出物料颗粒均匀度差、细粉多、颗粒分布不均等现象。审评中显现出容易忽略的问题是对输入的工艺参数研究不透彻、以及重复制粒依据不足。有文献[19]表明重复多次制粒会对物料粉体学特性,如粒度分布、堆密度以及流动性等有较大影响,同时也会影响后续压片时的可压性。另有文献[20]表明干法制粒工序如回收过多细粉,可能会影响API的均匀性。针对上述问题,申请人不但要详细考察工艺参数范围,如压轮压力、送料转速、辊轮转速、制粒速度、辊轮间隙以及整粒筛网孔径等,同时也要关注输入物料的属性如黏性、含水量、流动性等。
审评案例分析2:如某分散片采用干法制粒生产工艺,在制粒过程中主要收集24 目至80 目筛网的颗粒,大颗粒再次粉粹整粒,细粉再次进行制粒整粒,直至24 目至80 目筛网的颗粒与80 目筛网下细粉量之比为6∶1 至12∶1,制粒次数不多于4 次。由于该品种存在重复制粒,可能会有较硬、较大颗粒出现,导致粒度分布发生变化,进而可能影响终产品溶出度。而申报资料中缺少对重复制粒以及输出物料的粉体学性质的研究。为保证产品批间质量一致。